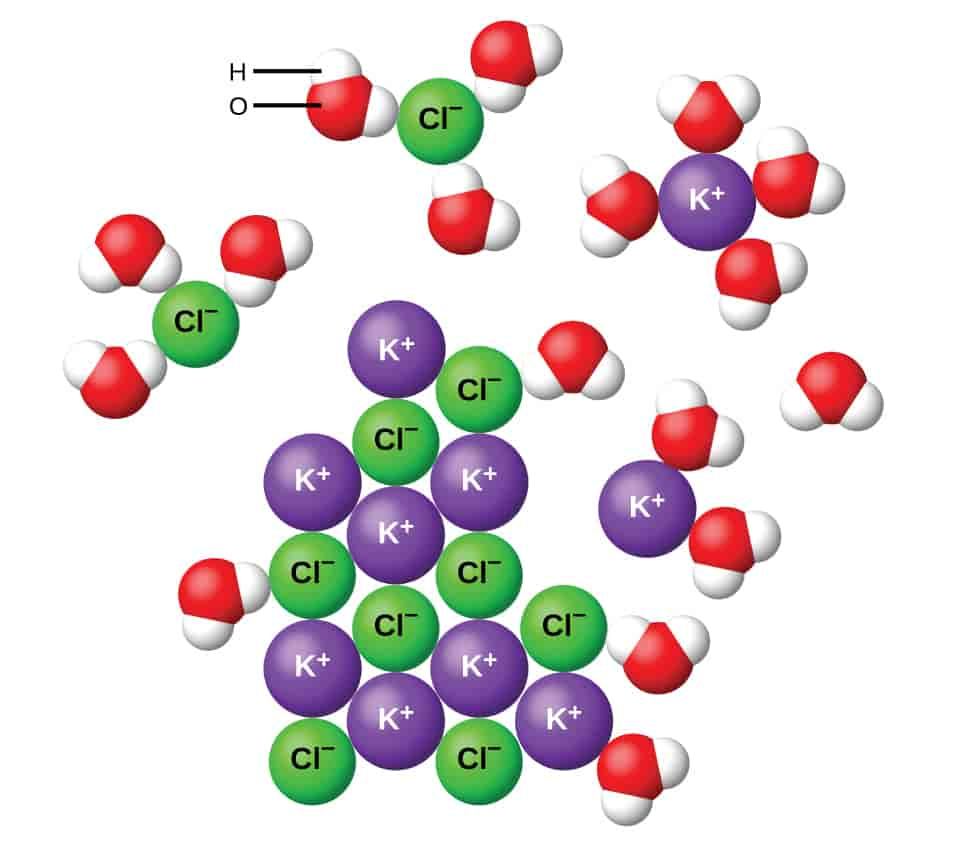
Dissosiasjon er en kjemisk prosess hvor molekyler spaltes i atomer, enklere molekyler, radikaler eller positive og negative ioner.
Faktaboks
- Uttale
- dissosiasjˈon
Ved termisk dissosiasjon er oppvarming årsak til spaltingen, mens ved fotokjemisk dissosiasjon skjer spaltningen ved bestråling, for eksempel av vanlig lys. Tidligere ble spalting i ioner ved oppløsning av et stoff i en væske kalt elektrolytisk dissosiasjon, men i dag vet vi at ionene er til stede i stoffet før oppløsningen.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.