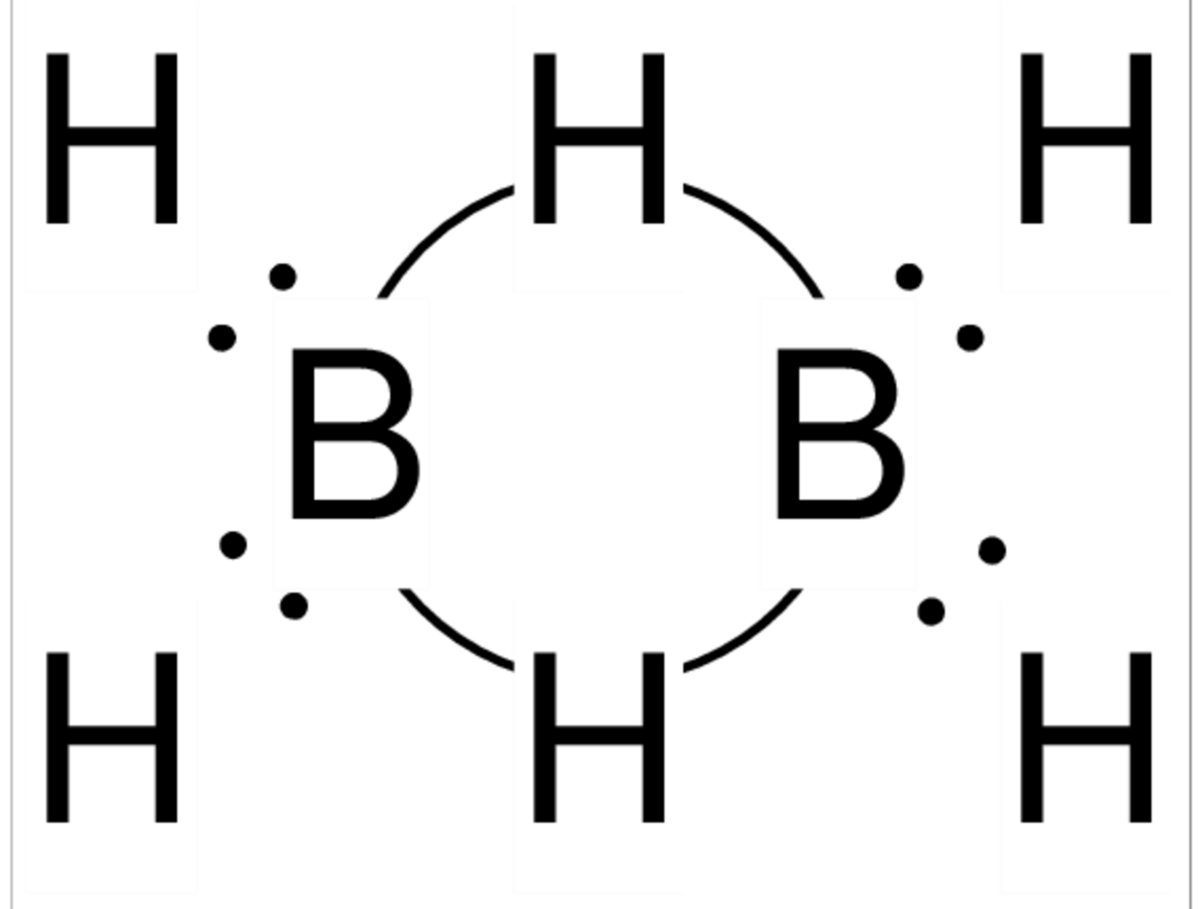
Boraner er fellesnavnet på kjemiske forbindelser mellom bor og hydrogen. De fleste boranene lar seg innordne i to grupper, den ene med den generelle molekylformelen BnHn+4 hvor n kan ha verdiene 2,5,6,8,10,16 og 18, den andre BnHn+6, hvor n kan ha verdiene 4,5,6,8,9 og 10. Dessuten finnes boraner som B8H16, B10H18 med flere. Den mulige, enkle forbindelsen BH3 er ikke kjent.
Faktaboks
- Uttale
- borˈaner
Det benyttes en spesiell nomenklatur på boraner. Først angis antall boratomer med greske tallord, deretter antallet hydrogenatomer med arabiske tall føyd til i parentes. For eksempel er navnet på B2H6 diboran(6).
Boranene er lite bestandige og til dels selvantennelige i luft. Flytende og gassformige boraner lukter motbydelig og fremkaller hodepine og ubehag. Om giftighet, se artikkelen om bor.
Boraner ble første gang fremstilt i 1912 av den tyske kjemikeren Alfred Stock (1876–1946). Særlig i tiden etter 1950 har boraner vært et fascinerende forskningsfelt som har kastet nytt lys over bindingsforhold i forbindelse med mangel på valenselektroner, noe blant annet William Lipscomb fikk Nobelprisen i kjemi for i 1976.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.