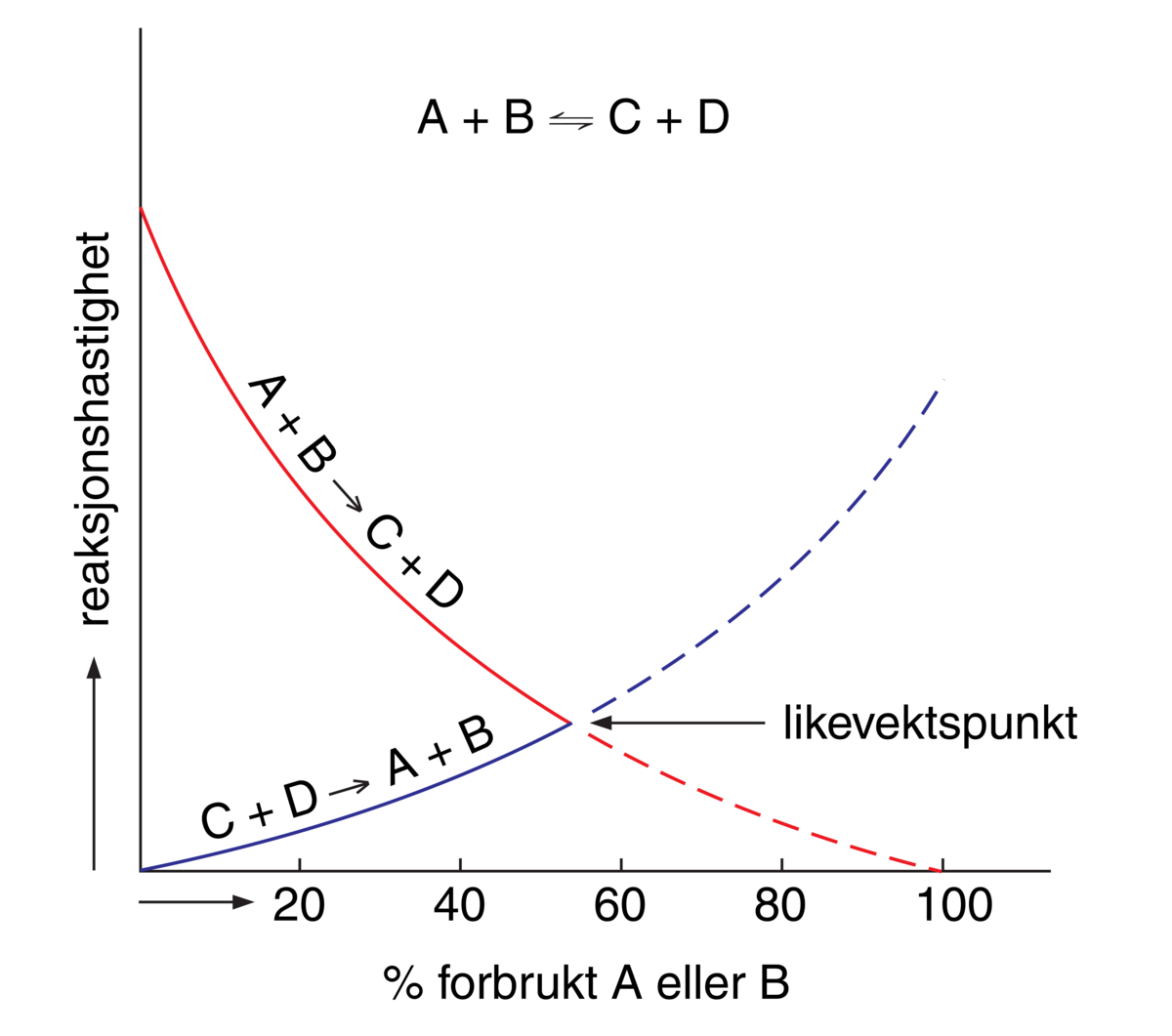
Noen kjemiske reaksjoner går raskt, andre langsomt. Alle kjemiske reaksjoner kommer til slutt i likevekt dersom de foregår i en lukket beholder, slik at stoffene som inngår i reaksjonene ikke vekselvirker med stoffer utenfra. Kjemiske likevekter er dynamiske, det vil si at selv om en likevekt er oppnådd, vil reaktantene fortsatt danne produkter, samtidig som produktene fortsatt reagerer og danner utgangsstoffene (substratene). Ved likevekt er konsentrasjonen av alle stoffene som deltar i reaksjonen konstant.
Man kan for eksempel se for seg en kjemisk reaksjon mellom to stoffer A og B, som fører til dannelse av produktene C og D. Reaksjonslikningen for denne reaksjonen kan skrives slik:
\[\ce{A + B} = \ce{C + D}\]
Ifølge massevirkningsloven vil forholdet mellom produktet av konsentrasjonene av utgangsstoffene ([A] × [B]) og produktet av konsentrasjonene av produktene ([C] × [D]) være konstant. Dette kan uttrykkes med følgende formel:
\[\ce{K} = \ce{\frac{[C] \cdot [D]}{[A] \cdot [B]}}\]
K kalles likevektskonstanten. Hver kjemiske reaksjon har sin unike likevektskonstant som er avhengig av temperaturen. En likevektskonstant må bestemmes gjennom eksperimenter.
Reaksjonen foregår mellom molekyler av stoffene A, B, C og D. [A], [B], [C] og [D] er den molare konsentrasjonen av de fire stoffene, oppgitt i mol per liter.
Massevirkningsloven er altså en kvantitativ lov som gjør det mulig å beregne konsentrasjoner av stoffer som inngår i en reaksjon, under gitte betingelser.







Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.