Før proteinfoldingen kan starte, må ribosomene lage kjeder av aminosyrer. Aminosyrekjeden må være helt ferdig før selve foldingen kan starte.
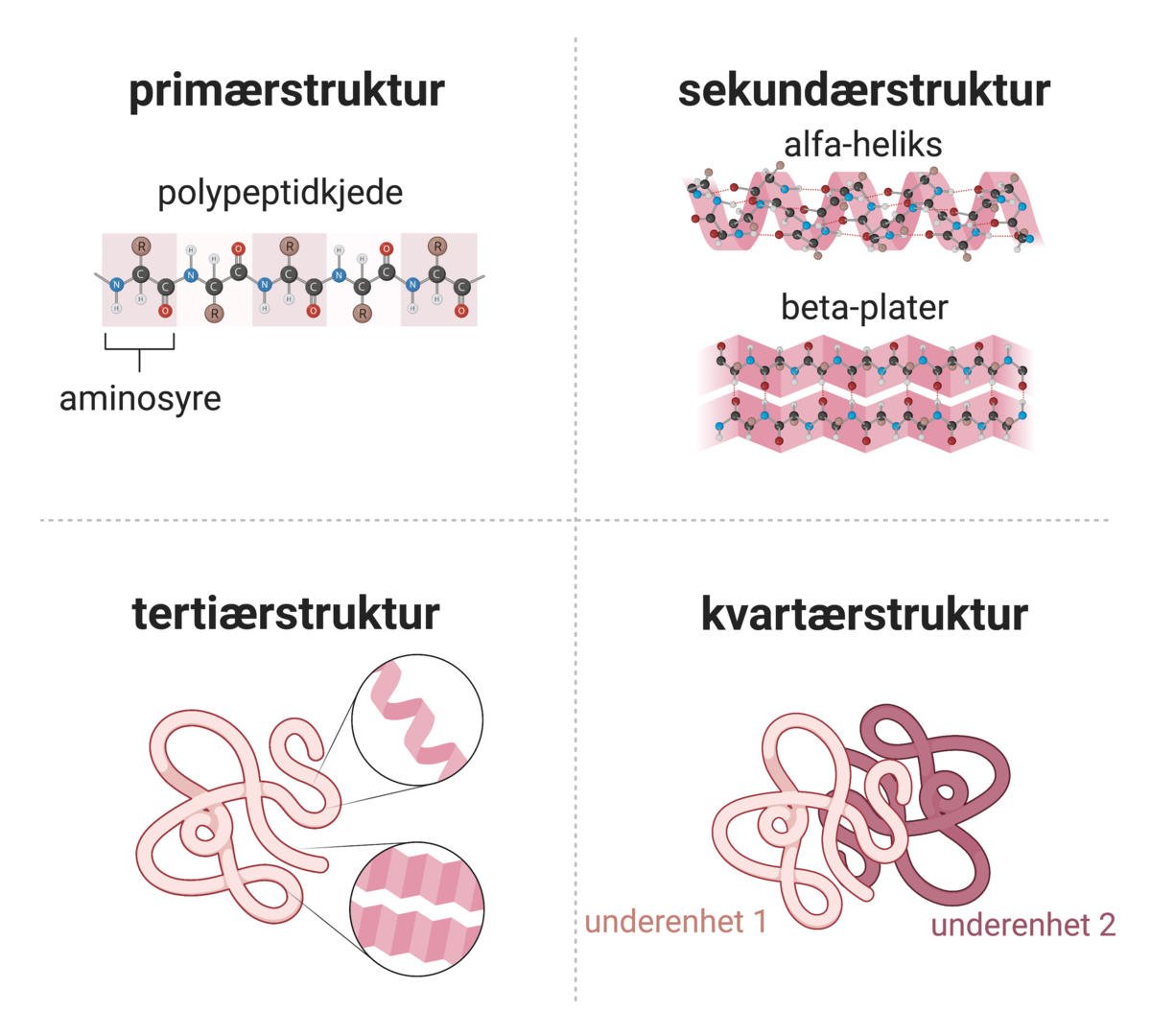
Proteinfoldingen deles inn i fire faser, etter fire strukturer: primær, sekundær, tertiær og kvartær. Disse strukturene angir de forskjellige nivåene av oppbygning i proteinet.
Primærstrukturen er rekkefølgen av aminosyrer. Denne rekkefølgen bestemmer i hovedsak hvordan proteinet foldes. Aminosyrenes sidekjeder påvirker hverandre og det skjer en rask sammentrekning av aminosyrekjeden. Dette resulterer først i dannelse av sekundærstrukturersom kalles alfa-helikser og beta-plater. Disse strukturene oppstår fordi det dannes hydrogenbindinger mellom atomer i kjeden av aminosyrer.
Sekundærstrukturene går sammen og danner en tredimensjonal tertiærstruktur. Denne strukturen stabiliseres av samspill mellom de funksjonelle (virksomme) gruppene til aminosyresekvensen. Av denne grunn er hydrofile/hydrofobe egenskaper, evne til å danne disulfidbroer og syre-/base-egenskaper viktige i dannelsen av tertiærstrukturen. Tertiærstrukturen kan være funksjonell i seg selv, men er det ikke nødvendigvis.
I tilfeller hvor tertiærstrukturen ikke er funksjonell alene, må den foldede polypeptidkjeden gå sammen med andre polypeptidkjeder for å danne et funksjonelt kompleks. Dette kalles kvartærstruktur. Et eksempel på et protein med kvartærstruktur er hemoglobin som består av fire aminosyrekjeder.


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.