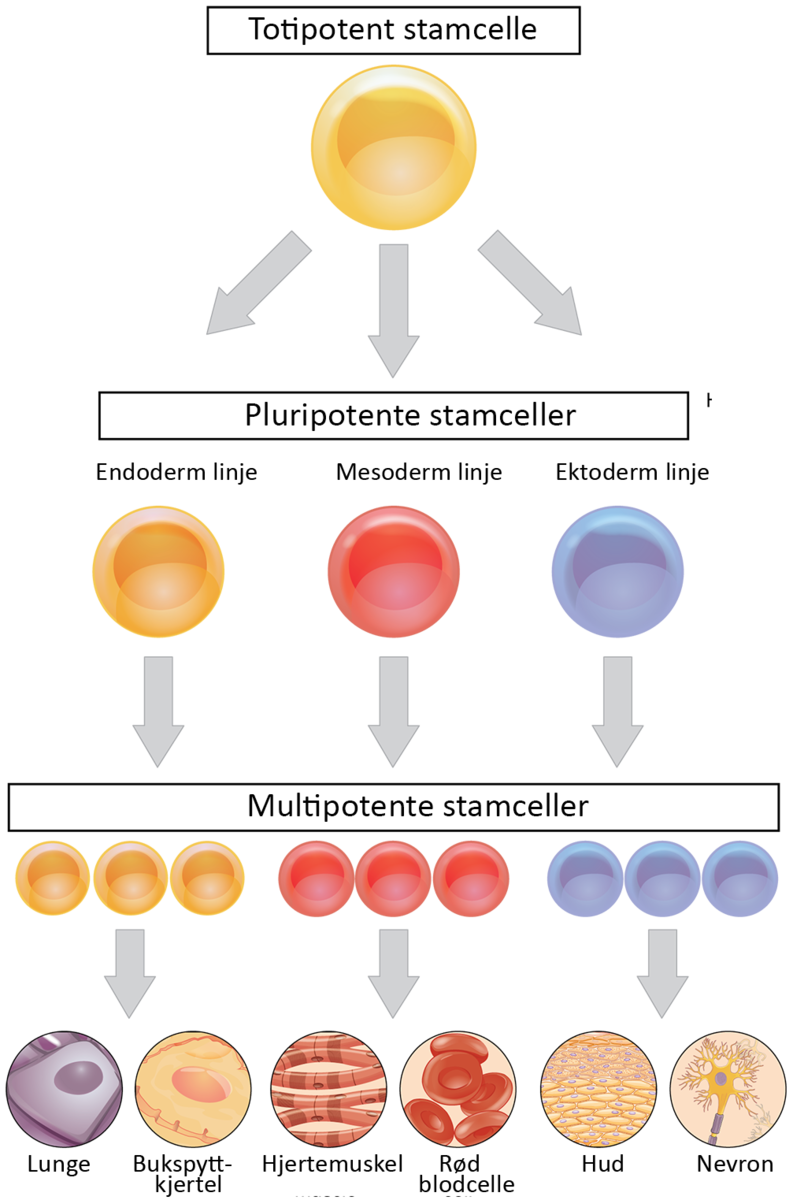
Stamcelle er en celle som kan gjennomgå selvfornyende celledeling og gi opphav til spesialiserte celler, som for eksempel en muskelcelle eller en blodcelle. Ved selvfornyende mener man at ved celledeling blir minst en av dattercellene en stamcelle, mens den andre kan bli til en spesialisert celle eller en stamcelle. Slik kan en stamcelle gi opphav til mange spesialiserte celler.
Celler som gir opphav til spesialiserte celler uten selvfornyende celledeling kalles gjerne progenitorceller. Flere typer stamceller er blitt definert ut ifra potensialet til å danne ulike typer spesialiserte celler og når og hvor i kroppen de finnes.
Når en celle går gjennom en spesialisering kalles det en differensiering.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.