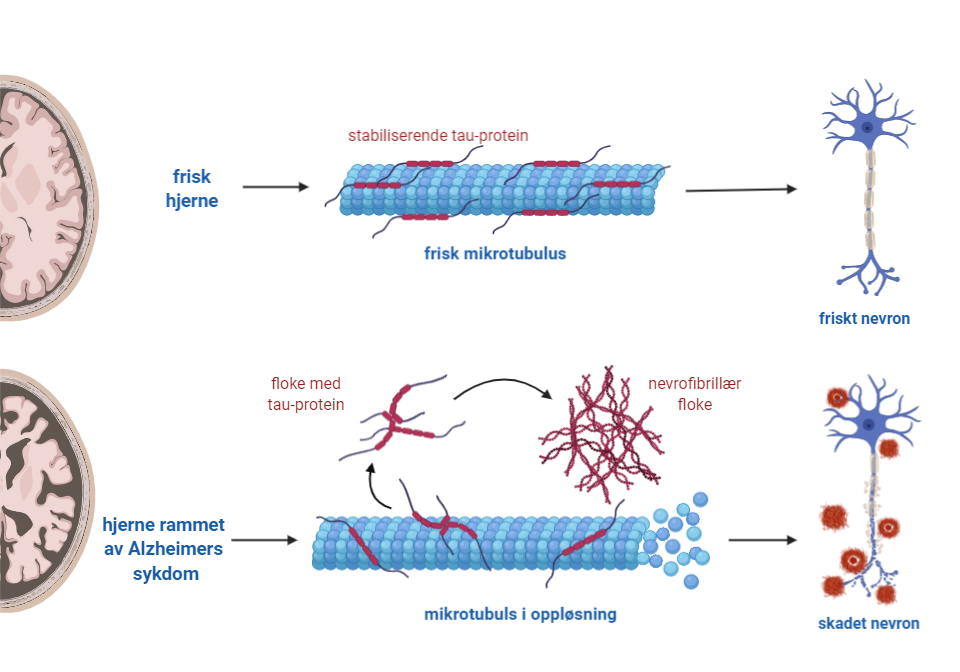
Tau-protein er et vannløselig protein som hovedsakelig finnes i nervecellene i sentralnervesystemet. Tau er viktig for stabiliseringen av nervecellenes skjelett (mikrotubuli) i aksonene, og bidrar til transport og signaloverføring i aksonet.
Tau-proteiner er i utgangspunktet fleksible og uordnede (ufoldede). De har blitt knyttet til en rekke sykdommer i sentralnervesystemet, blant annet demenssykdommen Alzheimers sykdom. Dersom det skjer en mutasjon i tau-genet eller tau-proteinet fosforyleres unormalt, kan det skje en opphopning av trådformet tau i nervecellene som danner såkalte nevrofibrillære floker. Store samlinger av slike nevrofibrillære floker kan føre til at viktige prosesser i cellen hemmes og at cellen dør.
Fellesbetegnelsen for sykdommer forårsaket av tau-proteinet er tauopatier.


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.