Sitronsyresyklus er en livsviktig prosess som foregår inne i mitokondriene i kroppens celler. Syklusen er en viktig del av stoffskiftet, hvor cellene omdanner næringsstoffer til energi og nye byggesteiner. Den kalles også krebssyklus eller trikarboksylsyresyklus.
Faktaboks
- Uttale
- sitrˈonsyresyklus
- Også kjent som
-
krebssyklus, tricarboxylic acid cycle, TCA
Reaksjonssyklusen er et knutepunkt i stoffskiftet til cellen. Den fungerer som en forbindelse mellom flere forskjellige reaksjonsveier. Sitronsyresyklus er en forbindelse mellom nedbrytning av sukker (glykolyse) og fett (beta-oksidasjon), fettsyreproduksjon, aminosyrestoffskiftet, nydannelse av sukker (glukoneogenese), og ureasyklus, for å nevne noe.
Sitronsyresyklus foregår i celler med mitokondrier. Dette inkluderer de aller fleste celler i kroppen. Aktiviteten til reaksjonsveien varierer ut ifra de forskjellige cellenes energibehov. Muskelceller og hjerneceller har mange mitokondrier, og spesielt høy aktivitet i sitronsyresyklus. Andre celler, som fettceller, har lavere aktivitet. Røde blodceller har ikke mitokondrier, og er derfor helt avhengige av energiproduksjon fra glykolyse.
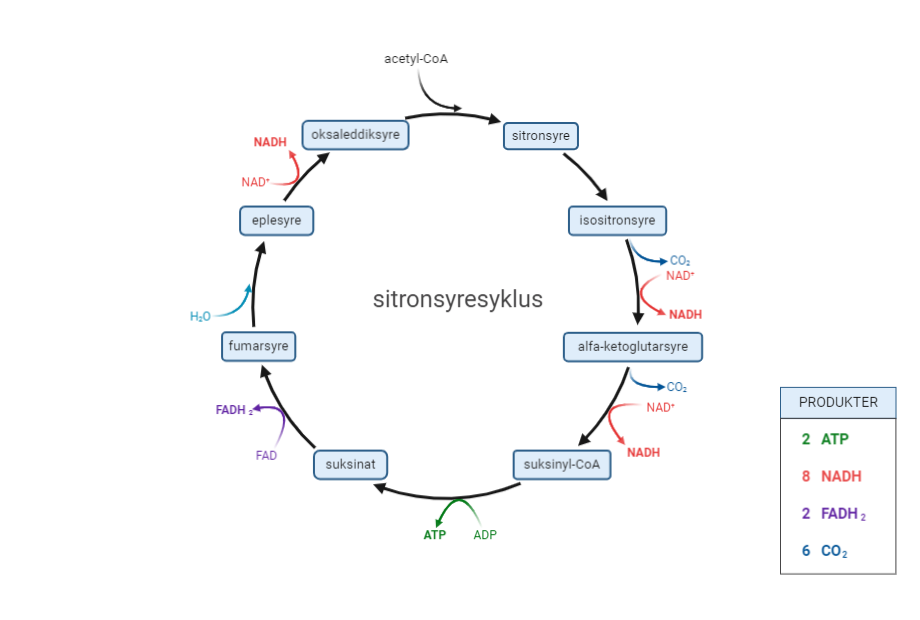
Når cellen bruker sitronsyresyklus for å produsere energi er det hovedsakelig acetyl-CoA som mates inn i syklusen. Acetyl-CoA er et stoff som er felles for sukkernedbrytning og fettsyrenedbrytning. Sitronsyresyklus kan også mates med stoffet alfa-ketoglutarat og enkelte andre stoffskifteprodukter fra nedbrytning av aminosyrer. Ved siden av energi produserer også sitronsyresyklus byggesteiner til syntese av nye stoffer, som fettsyrer, glukose, aminosyrer, steroler, puriner og heme-grupper.
I grove trekk består sitronsyresyklus av åtte reaksjoner hvor enzymer omdanner ulike substrater. Tre av reaksjonene i syklusen lader energirike elektronbærere (NADH og FADH2), som blir gitt energi i form av elektroner. Mitokondriene bruker elektronbærerne til å drive den ATP-produserende prosessen oksidativ fosforylering. Dette skjer ved at elektronbærerne gir elektroner videre til elektrontransportkjeden i mitokondriene, der energien brukes til å drive oksidativ fosforylering. En av reaksjonene i sitronsyresyklus produserer GTP, som tilsvarer ATP som energiforbindelse for cellen.
Sitronsyresyklus reguleres på bakgrunn av cellens energistatus og umiddelbare energiforbruk. Reguleringen foregår gjennom tilbakekoblingssløyfer og produkthemming. Reguleringen av sitronsyresyklus foregår allosterisk, som betyr at enzymene i reaksjonssyklusen har egne reguleringsseter der stoffskifteprodukter og andre allosteriske regulatorer binder til og påvirker enzymets funksjon. De viktigste regulatorene av sitronsyresyklus er kalsiumioner, ATP, ADP og NADH. Samtidig virker sitrat og suksinyl-CoA som produkthemmere av enzymene som katalyserer dannelsen av dem.




Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.