Polytrope tilstandsforandringer er en prosess som foregår i gassmengder som ekspanderer eller komprimeres, for eksempel under stempelbevegelsen i en sylinder.
Hvis varme tilføres eller fjernes fra en gassmengde, fås forskjellige polytrope tilstandsforandringer. Gassmengdens tilstand er bestemt av tre størrelser: trykk = p, volum = V, temperatur = T.
Tilstandsforandringene kan beskrives ved ligningen:
- p · Vn = konstant
Konstanten er avhengig av T, mens n kalles polytropeksponent.
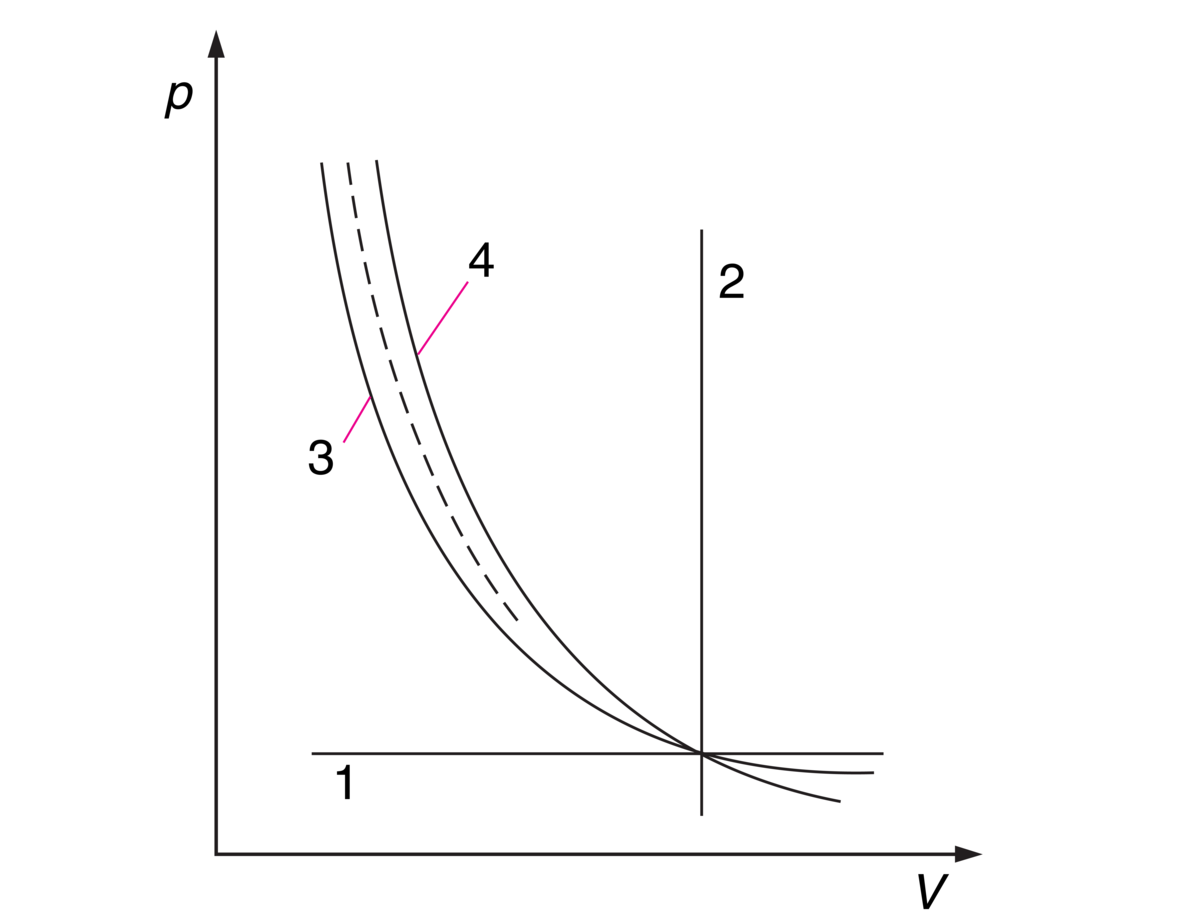
Følgende prinsipielle polytrope tilstandsforandringer er mulige:
1. Isobar: p = konstant, n = 0, V og T varieres, ved kjøling avtar V, ved oppvarming øker V.
2. Isochor: V = konstant, n = ∞, p og T varieres, ved kjøling avtar p, ved oppvarming øker p.
3. Isoterm: T = konstant, n = 1, V og p varieres, kjøling ved kompresjon, oppvarming ved ekspansjon.
4. Adiabat p · Vκ = konstant, n = κ, V, p og T varieres, ingen kjøling eller oppvarming utenfra.
For én-atomige gasser (for eksempel He, Ar) κ = 1,66, for to-atomige gasser (for eksempel O 2,N 2,H 2) κ = 1,40 og for treatomige gasser (for eksempel CO 2,SO 2) κ = 1,27.
De fleste praktiske polytrope tilstandsforandringer ligger mellom 3 og 4.


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.