Ioniseringsenergi er den minste energien som kreves for at et elektron skal løsrives fra det atomet eller molekylet som det er bundet til.
Faktaboks
- Uttale
- ionisˈeringsenergi
- Også kjent som
-
ionisasjonspotensial
Ioniseringsenergi er den minste energien som kreves for at et elektron skal løsrives fra det atomet eller molekylet som det er bundet til.
ionisasjonspotensial
Elektronene som er bundet i et atom befinner seg i bestemte energinivåer. Disse kan beregnes ved å bruke en fysisk teori kalt kvantemekanikk. For at et elektron skal kunne løsrives fra atomet, må det tilføres tilstrekkelig energi for å overvinne den elektrostatiske bindingen til den positivt ladede atomkjernen.
Energien som kreves for å ionisere atomet kan tilføres på forskjellig måte, for eksempel ved å bestråle atomet med lys. Lyset inneholder fotoner som kan «kollidere» med elektronene og på den måten overføre tilstrekkelig energi for ionisering. Det er det minst bundne elektronet, også kalt valenselektronet, som frigjøres.
I det enkleste atomet, hydrogenatomet, kan elektronet være bundet i forskjellige baner. Banene er gitt ved bindingsenergien E = –k/n2 , hvor konstanten k = 13,6 eV (elektronvolt) og n er nummeret på banen. Ioniseringsenergien for elektronet i den sterkest bundne tilstanden (grunntilstanden, der n = 1) blir da 13,6 eV.
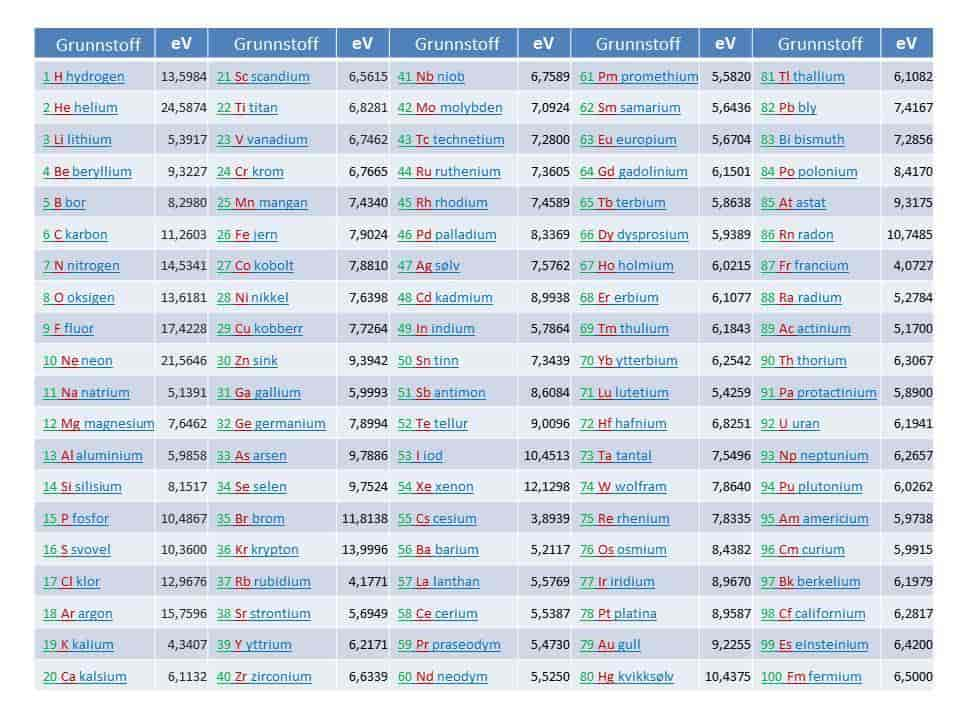
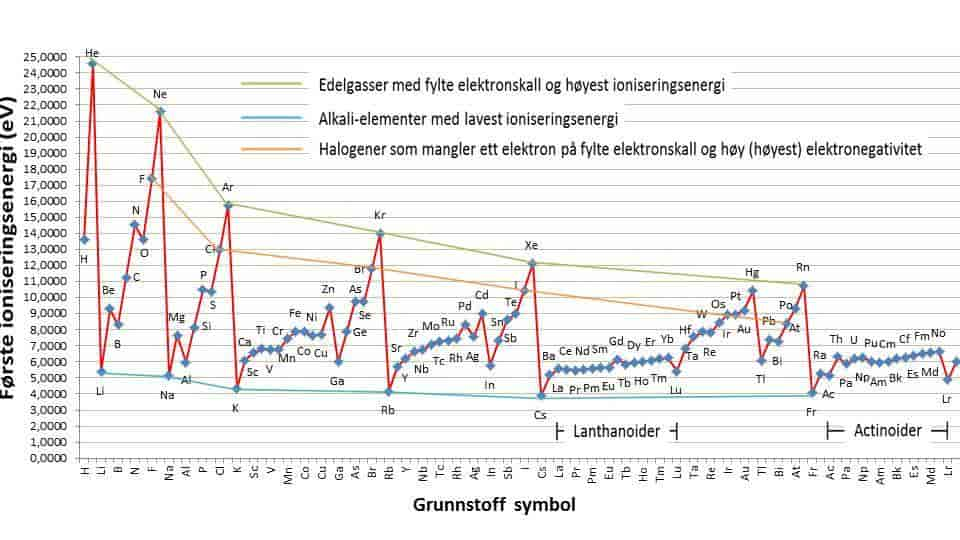
Første ioniseringsenergi er tabulert for grunnstoffene med atomnummer 1 – 100 i Figur 1. Verdiene er plottet i Figur 2 for å visualisere en viss systematikk. Vi ser at de høyeste ioniseringsenergiene tilhører edelgassene helium til radon og de laveste energiene tilhører alkalielementene lithium til francium.
Når det gjelder molekyler, defineres den første ioniseringsenergien som den minste energien et molekyl i gassfasen må tilføres for at et elektron skal kunne frigjøres fra molekylet. Når det skjer, dannes et positivt ladet ion.
På samme måte defineres andre ioniseringsenergi som den minste energien som må tilføres for at et dobbelt positivt ladet ion dannes. Denne er som regel adskillig høyere enn den første ioniseringsenergien.
Tidligere ble ofte betegnelsen ionisasjonspotensial brukt i stedet for ioniseringsenergi.
Ioniseringsenergi måles i elektronvolt, eV. For eksempel er ioniseringsenergien til nitrogen (N2) 15,60 eV, noe som tilsvarer 1506 kJ/mol. Måling av ioniseringsenergier gjøres ved bombardement med elektroner eller ved belysning med ultrafiolett lys. De dataene slike målinger gir er nødvendige for å forstå ionenes fysikk og kjemi.

Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.