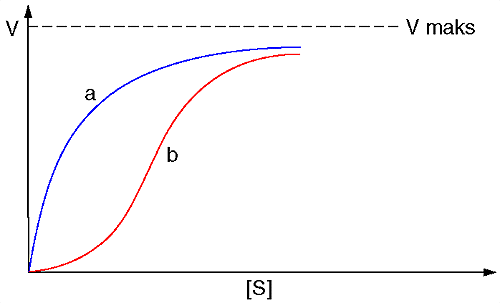
Enzymkinetikk er studiet av de forholdene som bestemmer hastigheten for enzymkatalyserte reaksjoner. I enzymreaksjoner omtales ofte hastigheten som V og substrakonsentrasjonen som [S].
Faktaboks
- Uttale
- ensˈymkinetˈikk
Tyskeren Leonor Michaelis (1875–1949) og kanadieren Maud Leonora Menten (1879–1960) viste i 1913 at for en enkel enzymatisk reaksjon ville dannelse av et enzymsubstratkompleks som mellomprodukt gi nettopp et slikt forløp. For reaksjonen
\[\ce{S + E <=>[\mathrm{k_1}][\mathrm{k_2}] ES ->[\mathrm{k_3}] E + P}\]
blir
\[\mathrm{V = \frac{V_{\text{maks}} \cdot [S]}{K_M + [S]}}\]
hvor k1, k2 og k3 er hastighetskonstanter for dannelse og nedbrytning av enzymsubstratkomplekset, karakteristiske for det gjeldende enzymet. Den maksimalt oppnåelige hastigheten, Vmaks, er lik k3 multiplisert med den totale enzymkonsentrasjon.


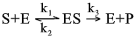
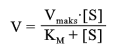
Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.