Oksygen transporteres fra luften i lungene til alle kroppens celler ved hjelp av blodet. I blodet foreligger oksygen på to måter: bundet til hemoglobin og fritt løst. Nesten alt oksygen (98 prosent) blir transportert bundet til hemoglobinmolekyler i de røde blodcellene. De resterende to prosentene er oppløst fritt i blodplasma og i de røde blodcellenes cytoplasma.
oksygentransport i blodet
Hemoglobin
Hemoglobin (Hb) er et oksygenbærende protein i de røde blodcellene. Hemoglobinet har som funksjon å transportere oksygenmolekyler fra lungene til alle kroppens organer, og transportere tilbake en liten andel, rundt 20 prosent, av CO₂-molekylene tilbake til lungene.
Hemoglobinmolekylet består av fire underenheter, og kalles derfor et tetramer. Hver underenhet består av en hemgruppe, hvor hver av hemgruppene har ett jernatom. Hvert jernatom er i stand til å binde ett oksygenmolekyl. Dermed kan hvert hemoglobinmolekyl binde fire oksygenmolekyler samtidig. Hemoglobin bundet til oksygen kalles oksyhemoglobin, mens ubundet hemoglobin kalles deoksyhemoglobin.
Hvis alle hemoglobinmolekyler i én liter blod er bundet til fire oksygenmolekyler, har blodet en oksygenmetning på 100 prosent. Ved 75 prosent oksygenmetning har hvert hemoglobinmolekyl i snitt bundet til tre oksygenmolekyler. 50 prosent oksygenmetning tilsvarer dermed i snitt to oksygenmolekyler per hemoglobinmolekyl.
Reaksjonen mellom oksygen (O₂) og hemoglobin (Hb) er en likevektsreaksjon, og kan skrives som:
Hb + O₂ ⇆ HbO₂ (oksygenbundet hemoglobin)
Ifølge Le Châteliers prinsipp vil en økning i partialtrykket av oksygen, gi en økning i HbO₂. Dermed er mengden oksygenmolekyler i blodet avgjørende for blodmetningen.
Oksygen-hemoglobin dissasosiasjonskurve
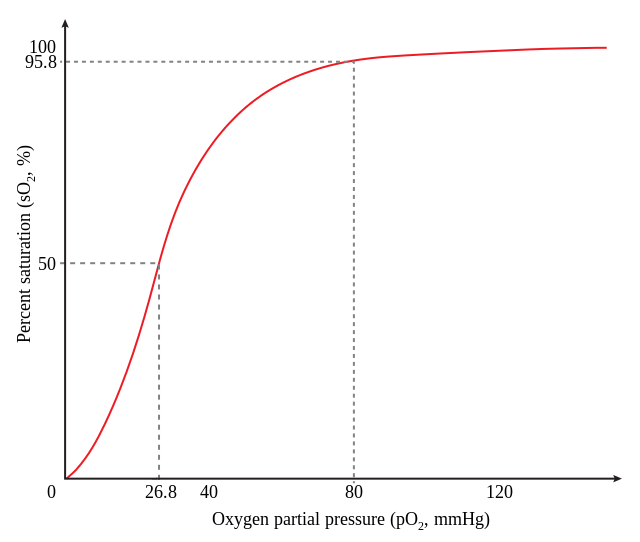
Oksygen-hemoglobin-dissosiasjonskurven, også kalt oksyhemoglobindissosiasjonskurve, viser sammenhengen mellom partialtrykket av oksygen (pO₂) og oksygenmetning. Forholdet mellom partialtrykk av oksygengass og hemoglobinmetning er ikke lineær, men har en S-form og kalles derfor en sigmoid kurve. Kurven øker bratt når pO₂ øker fra cirka 1,5 til 8 kPa. En videre økning i pO₂ gir kun en liten økning i hemoglobinmetning.
Den sigmoide formen på dissosiasjonskurven skyldes at oksygenmolekyler bundet til hemoglobin er samarbeidende. Oksygenbinding til en av hemoglobins hemgruppe øker affiniteten (tiltrekningskraften) for de ledige hemgruppene. Dette betyr at hemoglobinets evne til å binde oksygenmolekyler, øker med antall oksygenmolekyler som allerede er bundet til hemoglobinet. Den samarbeidende bindingen av oksygenmolekyler gjør at hemoglobin bundet til tre oksygenmolekyler har en affinitet som er omtrent 300 ganger større enn deoksyhemoglobin.
Faktorer som påvirker hemoglobins affinitet
Økt temperatur reduserer hemoglobins affinitet til oksygenmolekyler, og fører dermed til en høyreforskyvning i oksyhemoglobins dissosiasjonskurve.
Økt intracellulær pCO₂ reduserer hemoglobinets affinitet til oksygenmolekyler, først og fremst ved å redusere pH-verdien i de røde blodcellene. Dette er kjent som Bohr-effekten, og ble oppdaget av den danske fysiologen Christian Bohr i 1904. En økning i ekstracellulær pCO₂ vil gi en økning i intracellulær pCO₂ i røde blodceller, fordi mer karbondioksid diffunderer gjennom cellemembranen.
Karbondioksid reagerer med vann (H₂O) etter likningen:
CO₂ + H₂O ⇆ H2CO³ ⇆ H+ + HCO³-
Ifølge Le Châteliers-prinsipp vil en økning i CO₂ gi en høyreforskyvning av likevekten, og dermed en økt konsentrasjon av H+. Økt H+-konsentrasjon vil igjen redusere i surhetsgraden (pH-verdien).
2,3-Difosfoglyserat, forkortet 2,3-DPG, er et stoffskifteprodukt i glykolysen som også spiller en stor rolle i å bestemme hemoglobinmolekylenes affinitet til oksygenmolekyler. Når 2,3-DPG bindes til hemoglobinmolekylet, vil bindingen mellom hemoglobin og oksygenmolekylet bli svekket. Økt konsentrasjon av 2,3-DPG gir dermed en økt frigivning av oksygenmolekyler fra hemoglobin.
Hemoglobinet vi har i fostertiden, føtalt hemoglobin, har en mye mindre affinitet til 2,3-DPG, og har derfor i sum en høyere affinitet for oksygenmolekyler. Dette er en kritisk forskjell mellom føtalt og voksent hemoglobin (HbF og HbA), og spiller en viktig rolle i at de røde blodcellene hos fostre kan trekke ut oksygenmolekyler fra mors blod i morkaken.
Metabolsk aktivt vev, som for eksempel en hardtarbeidende muskel, har et høyt oksygenbehov og avgir samtidig høye mengde varme, CO₂ og 2,3-DPG. Høy konsentrasjon av karbondioksid gir en lavere pH-verdi. Disse faktorene øker frigivningen av oksygen i metabolsk aktivt vev.
I lungekapillarene er verdiene motsatt – det er lavere temperatur, lav pCO₂ og høyere pH, noe som dermed øker hemoglobins affinitet til oksygenmolekyler, og øker oksygenopptak.
Les mer i Store norske leksikon





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.