Redokspotensial er et mål på styrken og retningen elektroner forflytter seg mellom stoffer.
Faktaboks
- Også kjent som
-
Reduksjonsoksidasjonpotensial, reduksjonspotensial, standard redokspotensial, Eo , Eh.
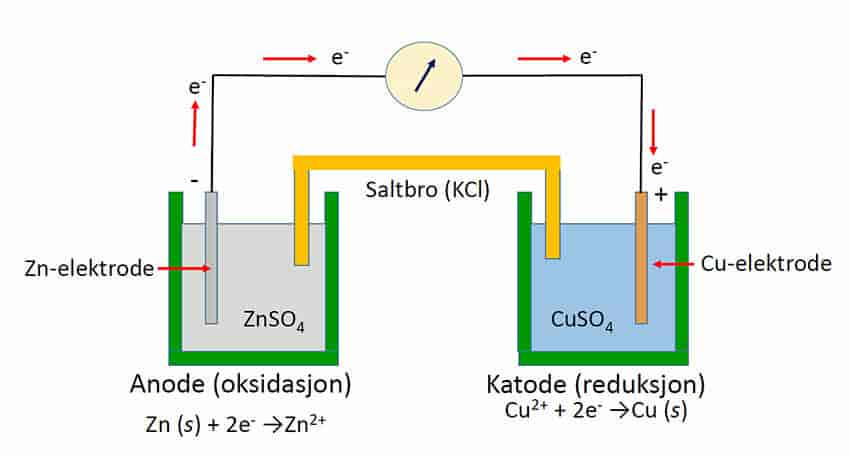
Stoffer som avgir elektroner blir oksidert, mens stoffer som mottar elektroner blir redusert. I kjemiske reaksjoner hvor elektroner overføres mellom stoffer (redoksreaksjoner) vil det alltid være et stoff som gir fra seg elektron og et som mottar. De to stoffene danner et redokspar. Redoksreaksjoner er svært utbredt og er fundamentalt i oppbygging av biologiske stoffer (for eksempel fotosyntese) til nedbrytning eller celleånding (for eksempel vedfyring og glykolysen).
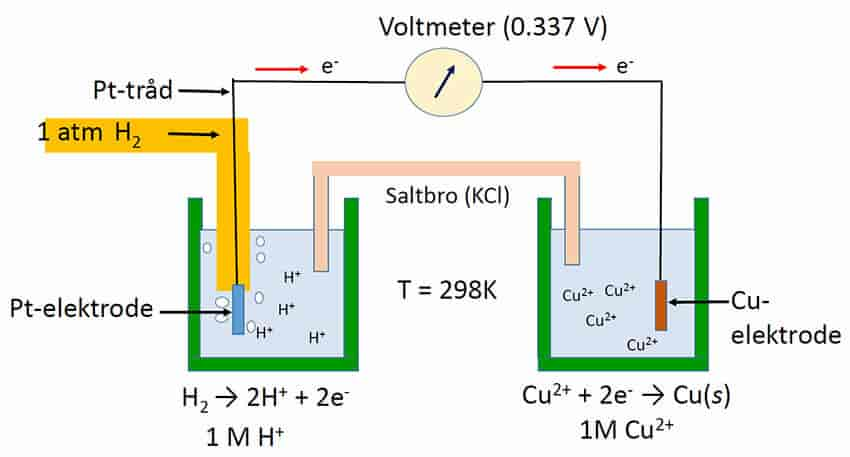
Redokspotensialet har måleenhet volt (V) eller millivolt (mV). Forskjellen i redokspotensial mellom to redokspar angir hvor mye energi som er tilgjengelig for arbeid ved å flytte elektroner, elektronstyrken. Redokspotensialet kan forklare i hvilken retning elektroner vil bevege seg i elektrontransportkjeder i cellerespirasjon, fotosyntese og andre biologiske redoksreaksjoner, samt innen elektrokjemi (elektrolyse, energilagring i batterier, brenselsceller). Alle potensialer er en referanse, og nullpunktet for et redokspotensial er en standard hydrogenelektrode.


Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.