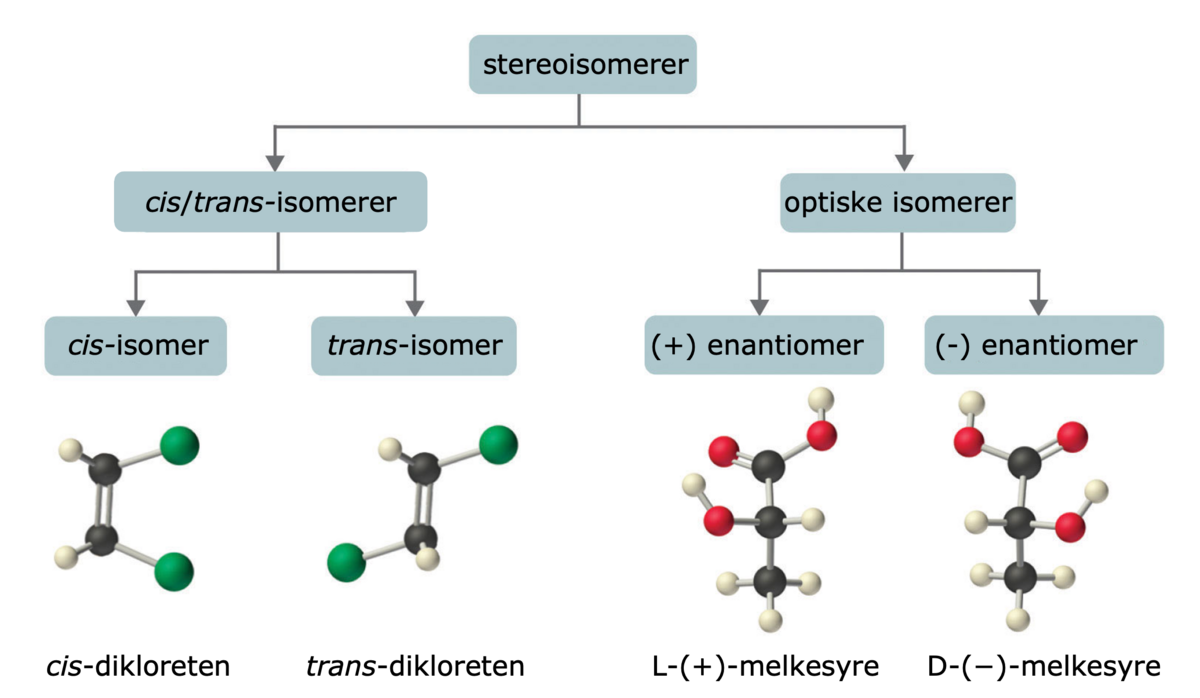
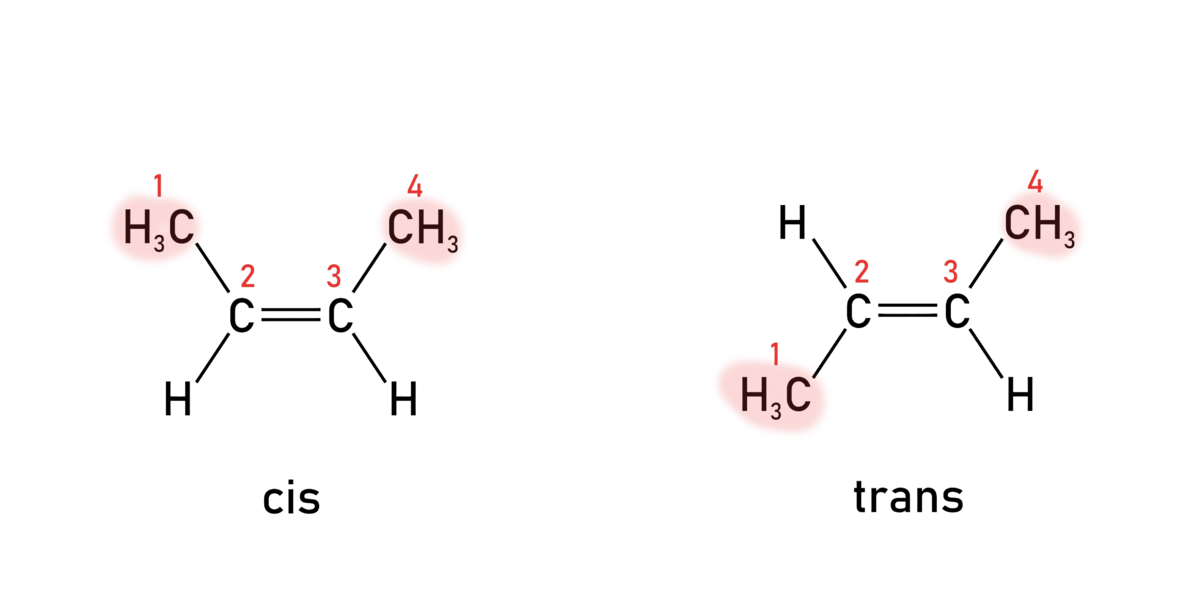
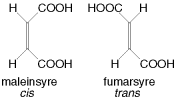
Forbindelser som inneholder dobbeltbindinger som har to ulike atomer/grupper festa til hver av sidene i dobbeltbindinga, vil forekomme som cis/trans-isomerer. Et eksempel er de to but-2-en-1,4-disyrene (trivialnavn maleinsyre og fumarsyre).
Maleinsyre har de to største gruppene pekende ut fra dobbeltbindinga til samme side (begge til høyre, når dobbeltbindinga er plassert loddrett). Da kalles dobbeltbindinga og dermed hele forbindelsen for cis. I fumarsyre peker de to største gruppene ut til hver sin side (øverste til venstre, nederste til høyre). Da kalles dobbeltbindinga og forbindelsen trans.
cis/trans-isomerer er vanlige både i naturen og i kjemien. Selv om forbindelsene er nesten helt like, er hver av dem stabile forbindelser, så vi får ikke blanding av både cis- og trans-forbindelsen om vi har en ren isomer. Unntak fra dette er karotenoider, som har mange dobbeltbindinger etter hverandre i molekylet. Et trans-karotenoid kan bli omdanna til en cis-forbindelse eller en di-cis-forbindelse, der en eller to av trans-dobbeltbindingene går fra trans til cis.
I kjemisk navnsetting er cis og trans ikke lenger gyldige begreper, unntatt for karotenoider. Istedenfor brukes E og Z. Da er det ikke størrelsen på «påhengene» til dobbeltbindinga som betyr noe, men hvor mange protoner naboatomene til dobbeltbindinga har. Oftest vil cis og Z være samme forbindelse, og trans og E være samme forbindelse, og dette gjelder alltid der dobbeltbindinga har et H-atom festa til hvert karbonatom.





Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.