Celleånding er levende cellers nedbrytning av energirike næringsstoffer som karbohydrater, fett og proteiner. I nedbrytningen frigjøres det energi som brukes i mange av cellens oppgaver, som oppbygging av proteiner, transport over membraner, bevegelse og reproduksjon.
Celleånding er en svært viktig biokjemisk prosess og er en forutsetning for alt liv på jorden.
Når vi i dagligtale sier at vi forbrenner karbohydrater, proteiner og fett, så betyr det egentlig at de brytes ned i celleåndingen.
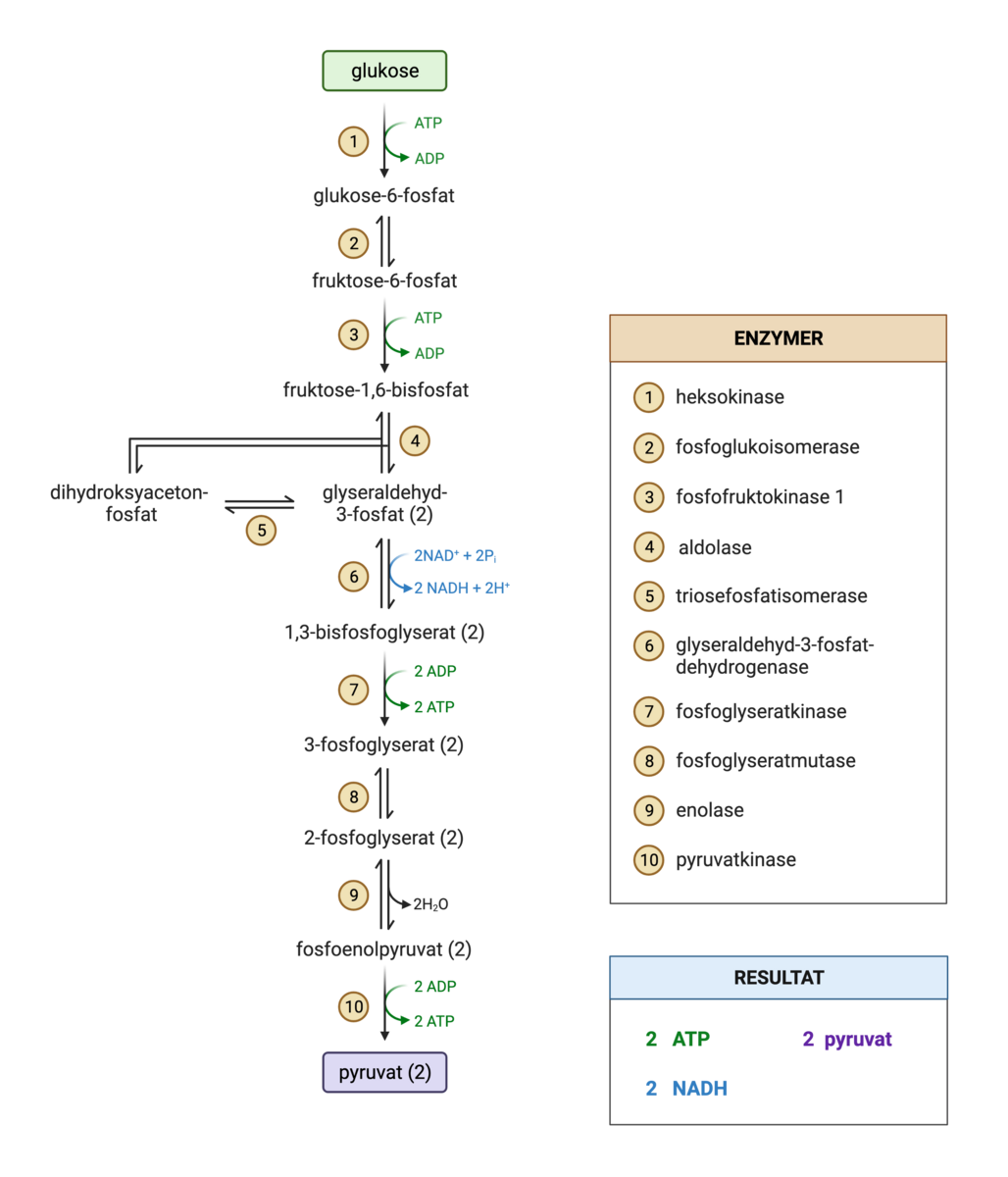
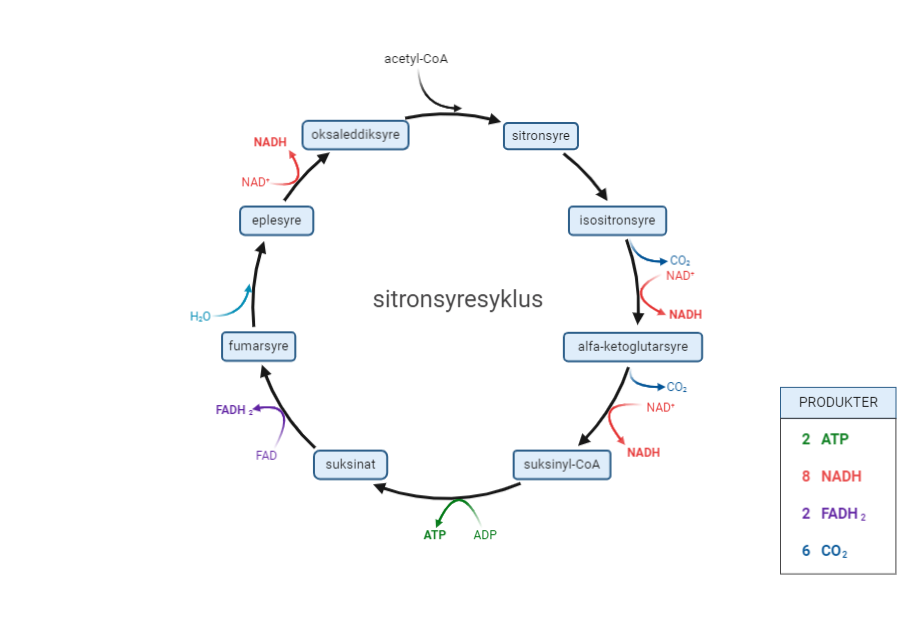
Energirike næringsstoffer som for eksempel glukose (sukker) er store molekyler. De inneholder mye potensiell energi i de kjemiske bindingene mellom atomene. Cellene kan ikke nyttiggjøre seg av all den potensielle energien i glukosen direkte. Derfor må glukose brytes ned for å frigjøre energien. Energien omdannes i hovedsak til ATP. Nedbrytningen består av flere trinn med blant annet redoksreaksjoner. Dette gjør at mest mulig av den potensielle energien gjøres tilgjengelig for cellen.
Slik nedbrytning av molekyler kalles katabolske prosesser. Oppbygging av molekyler som for eksempel proteiner i proteinsyntesen eller glukose i fotosyntesen kalles anabolske prosesser. Katabolske prosesser og anabolske prosesser kalles til sammen for stoffskifte eller metabolisme.
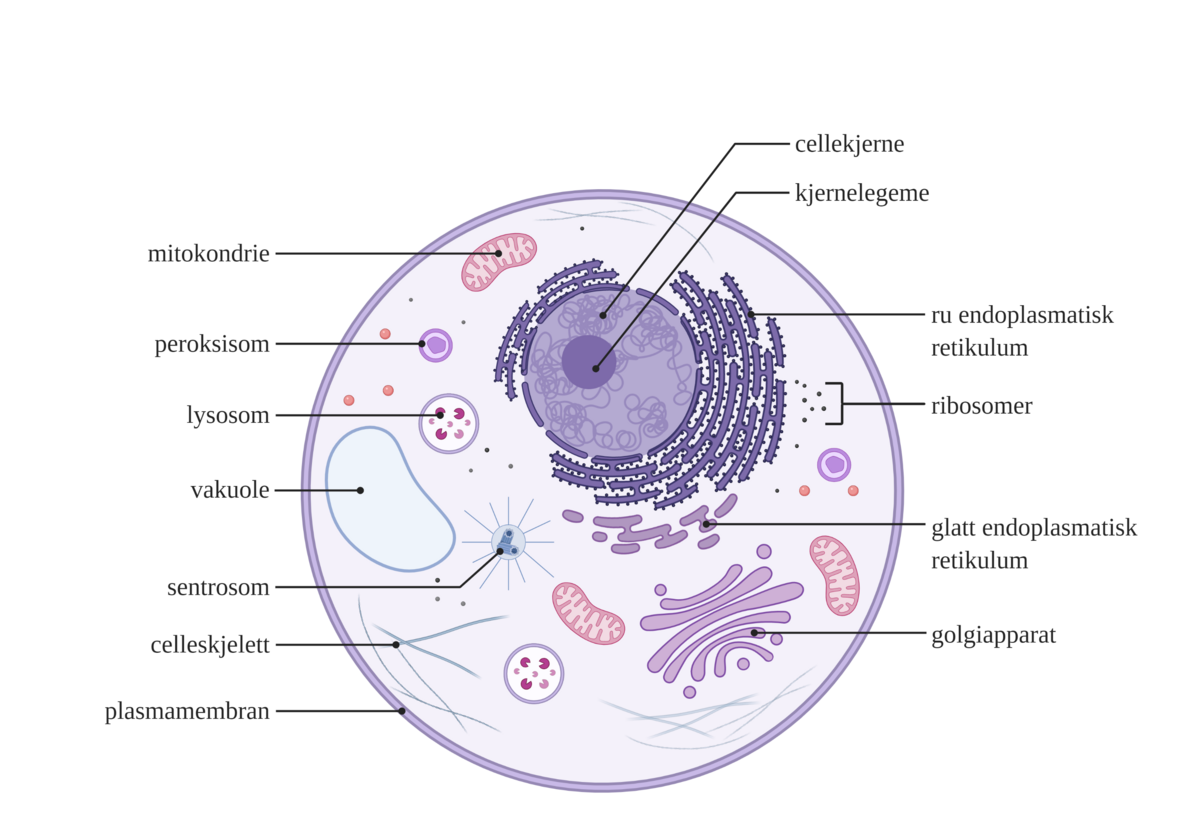
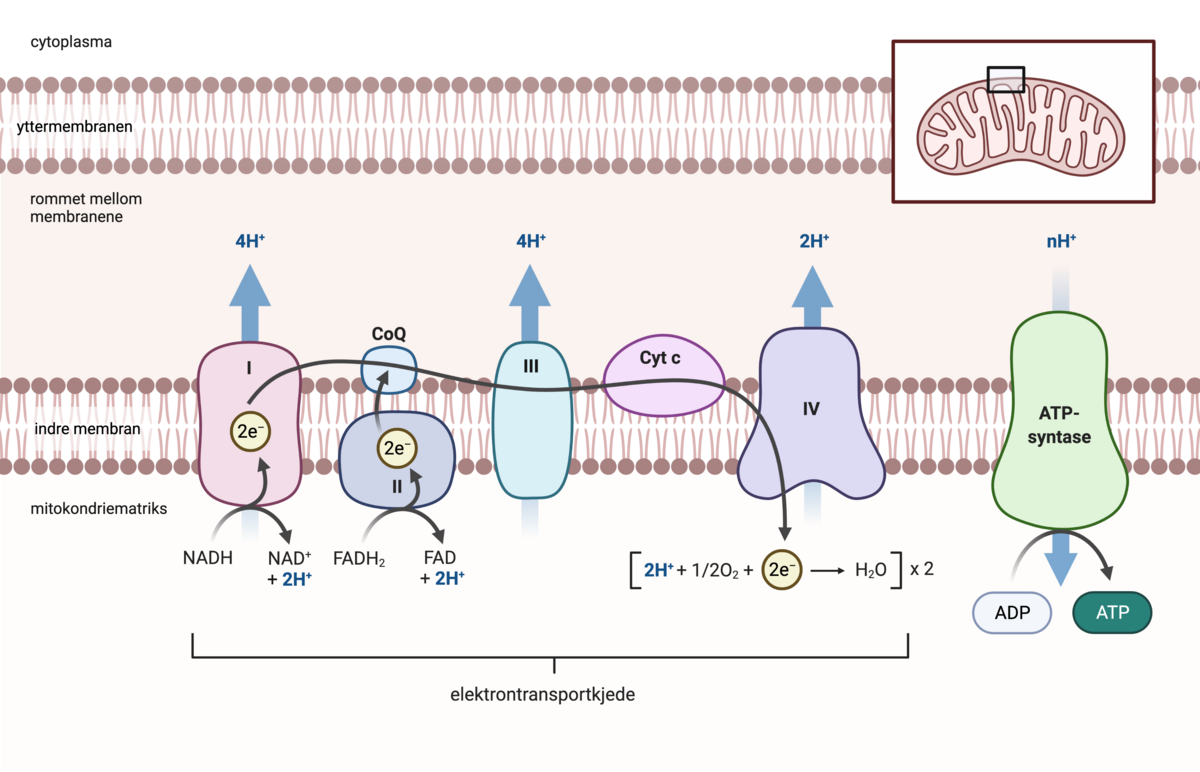
I eukaryote celler foregår celleåndingen i cytosol og i mitokondriene. I prokaryote celler foregår celleåndingen i cytosol og i plasmamembranen.
I de aller fleste organismer inngår oksygen som en viktig komponent i celleåndingen, og da kalles det aerob celleånding. Hvis disse cellene mangler oksygen, vil de drive ufullstendig celleånding, kalt fermentering (gjæring). Enkelte bakterier og arker driver celleånding med andre molekyler enn oksygen, som for eksempel sulfat. Da kalles det anaerob celleånding. Både fermentering og anaerob celleånding foregår altså uten oksygen tilstede, og fermentering omtales derfor ofte som en anaerob prosess.









Kommentarer
Kommentarer til artikkelen blir synlig for alle. Ikke skriv inn sensitive opplysninger, for eksempel helseopplysninger. Fagansvarlig eller redaktør svarer når de kan. Det kan ta tid før du får svar.
Du må være logget inn for å kommentere.